Discusión del caso clínico. | Presentación |
OBJETIVOS:
- Revisar causas de hipoxemia y sus mecanismos fisiopatológicos.
- Analizar la fisiopatología del Síndrome hepatopulmonar.
- Evaluar causas de disnea en pacientes con cirrosis.
- Repasar recomendaciones sobre el tratamiento de hepatitis C.
- Consideraciones finales.
Causas de hipoxemia y sus mecanismos fisiopatológicos:
Una adecuada ventilación perfusión es necesaria para asegurar un correcto intercambio de gases. A continuación se detallan las causas más frecuentes de hipoxemia.
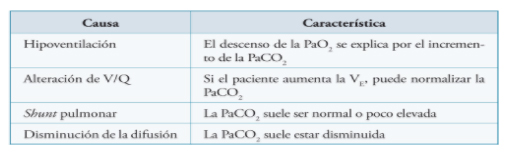
El Shunt pulmonar representa el extremo del desequilibrio V/Q. Se produce cuando la sangre venosa mixta perfunde áreas extensas del pulmón no ventiladas y no se enriquece en O2, produciendo mezcla venosa y empobreciendo el contenido arterial de O2. Las patologías que cursan con shunt cursan con hipoxemia, hipopcapnia y aumento del gradiente alveolo arterial de O2 (A-aO2). La oxigenoterapia resulta poco efectiva ya que la sangre venosa de las áreas no ventiladas no se puede poner en contacto con el O2. Las unidades alveolares sanas con relación V/Q conservada y la hiperventilación compensadora pueden producir hipocapnia y corregir algo la hipoxemia.
Las malformaciones cardiacas y vasculares, congénitas y adquiridas (fístulas arteriovenosas, comunicaciones intracardiacas, cardiopatías congénitas) producen el mismo efecto pero en este caso por mezcla arterio-venosa extrapulmonar.
En el síndrome hepatopulmonar se produce un tránsito acelerado intrapulmonar que tiene el mismo efecto. Debido al antecedente de dicha enfermedad en nuestro paciente, voy hacer una revisión de la misma a continuación.
Síndrome hepatopulmonar (SHP):
Es una causa de hipoxemia en pacientes con enfermedad hepática, debido a una vasodilatación intrapulmonar anormal, que conduce a un exceso de perfusión en relación a la ventilación.
El SHP ha sido clásicamente definido por la tríada de enfermedad hepática avanzada, vaso-dilatación intrapulmonar localizada o difusa, e hipoxemia con aumento de la diferencia alvéolo-arterial de oxígeno (PA-a02) respirando aire ambiental (> 15 mm Hg en los menores de 64 años y > 20 mmHg en los mayores de 64 años).
Epidemiología El SHP se observa principalmente en pacientes de mediana edad (generalmente diagnosticado en la sexta década de la vida) sin diferencia entre sexos aunque también puede verse en niños. La prevalencia del SHP varía entre las series, según los criterios y los métodos diagnósticos utilizados y la población estudiada, entre el 4 y el 44%. En pacientes con cirrosis, la prevalencia media de SHP es del 15%, dependiendo del valor de corte para la PaO2 utilizado para definir esta entidad y/o del medio de cálculo del PA-aO2.
Fisiopatología del Síndrome Hepatopulmonar: La causa de la hipoxemia en el SHP es la marcada dilatación de los vasos precapilares y poscapilares junto con un incremento en el número de vasos dilatados. Además, se pueden observar algunas comunicaciones arteriovenosas pulmonares y pleurales (shunts) y anastomosis portopulmonares. Todo ello, permite que la sangre venosa hipooxigenada pase rápidamente a las venas pulmonares, con la consiguiente disminución de la oxigenación de la sangre arterial.
Los tres mecanismos intrapulmonares causantes de la hipoxemia en el SHP son:
- Desequilibrio de la relación ventilación/perfusión causado por la existencia de alvéolos hiperperfundidos.
- Shunt intrapulmonar causado por áreas de desequilibrio de ventilación/perfusión extrema.
- Fracaso de la disminución de la difusión de oxígeno, al tener que recorrer las moléculas de oxígeno un espacio ampliado por la vasodilatación pulmonar (defecto de la difusión-perfusión). Además, un estado de circulación hiperdinámica puede condicionar una circulación pulmonar más rápida, que puede dificultar el intercambio gaseoso.
Se ha planteado que la vasodilatación a nivel pulmonar se debe al incremento de la producción vascular de moléculas vasodilatadoras, particularmente del óxido nítrico (NO). Se cree que existe un aumento de la producción de endotelina-1 (ET-1) en el hígado y en el epitelio biliar, que aumentaría la expresión de la enzima NO sintetasa endotelial (eNOS) en la circulación pulmonar, mediante la activación de receptores de ET-1 tipo B. En este SHP experimental, se ha observado además una acumulación de macrófagos intravasculares, los cuales transitoriamente producen NO sintetasa inducible (iNOS) y, progresivamente, hemoxigenasa tipo 1, agregándose además monóxido de carbono como agente patogénico. En definitiva, el trastorno fisiopatológico del SHP se debería a un tono vascular anormal con pérdida de la auto-regulación del flujo pulmonar y vasodilatación extrema.
Clínica
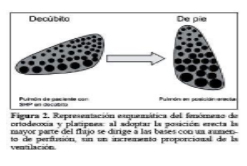
El síndrome se manifiesta típicamente por la presencia de disnea progresiva, que empeora en posición erecta y mejora con el decúbito (platipnea), en el contexto de un paciente con hipertensión portal. A lo anterior puede agregarse (caída de un 5% o más de 4mmHg en la PaO2 cuando el paciente cambia de la posición decúbito supina al ortostatismo) lo cual se traduce en una mayor disnea (platipnea) relacionada con un desequilibrio de la ventilación-perfusión, en un 20-80% de los casos, cuya magnitud es proporcional a la gravedad del SHP, considerando que ésta también puede verse en otras patologías tales como embolia pulmonar recurrente, comunicación interauricular y post-neumonectomía. En el examen físico, se destacan la presencia de hipocratismo digital y telangiectasias aracniformes, que se describen como los marcadores físicos más sensibles. En las etapas avanzadas, es frecuente encontrar cianosis de labios y lechos ungueales.
El paciente presentaba platipnea, hipocratismo digital y ortodeoxia.
La representación esquemática del fenómeno de ortodeoxia y platipnea: al adoptar la posición erecta la mayor parte del flujo se dirige a las bases con aumento de perfusión, sin un incremento proporcional de la ventilación.
Pruebas diagnósticas:
Laboratorio:
La gasometría arterial nos permitirá definir el componente de hipoxemia tal y como se ha definido con anterioridad. Además, nos permitirá evaluar la gravedad del SHP según el grado de hipoxemia, siempre con un PA-aO2 ≥ 15mmHg (≥ 20mmHg en mayores de 65 años).
Ecocardiograma doppler con burbujas:
Actualmente se considera como el estándar de oro para el diagnóstico de las dilataciones vasculares pulmonares en el SHP. Tras la administración de salino agitado a través de una vena periférica del brazo, la existencia de una opacidad de la aurícula izquierda dentro de 3 a 6 ciclos cardiacos después de la opacidad de la aurícula derecha indica el paso de microburbujas a través de un árbol vascular anormalmente dilatado. En el SHP las burbujas pasan a través de los capilares pulmonares dilatados, alcanzan la circulación general y son también visibles en las cavidades izquierdas del corazón (cortocircuito derecha-izquierda).
En el paciente normal, las burbujas se verán sólo en las cavidades cardíacas derechas, ya que serán filtradas por la red capilar pulmonar. En pacientes con SHP, se observan burbujas en la aurícula izquierda luego de 3 a 6 latidos, lo que sugiere la presencia de un shunt intrapulmonar y descarta uno intracardíaco en el cual las burbujas se visualizarían antes del tercer latido.
Si bien, la ecocardiografía transesofágica detecta shunts con mayor sensibilidad, identifica directamente el septo interauricular, la posible existencia de un shunt derecha-izquierda, y muestra directamente el paso de microburbujas hacia la aurícula izquierda a través de un defecto del septo. Este último método puede aumentar la sensibilidad en casos de duda con el ecocardiograma. No se justifica su uso rutinario por su costo, menor disponibilidad y mayores riesgos, por posibles várices esofágicas. El estudio ecográfico además ofrece la posibilidad de detectar anomalías estructurales, evaluar función ventricular y descartar hipertensión pulmonar.
El ecocardiograma doppler con burbujas fue positivo en el paciente, evidenciándose la presencia de burbujas entre el 3 y 6 latidos.
Otra técnica para evidenciar la cuantía del shunt es la cintigrafía pulmonar usando macroagregados de albúmina marcada con Tc99m; se basa en que las moléculas de albúmina marcadas 99mTc, al tener un tamaño 4 veces mayor que el capilar pulmonar en condiciones normales quedan atrapadas en el lecho capilar pulmonar. La relación de cuentas radiactivas entre el pulmón y un órgano de circulación estable como el cerebro permite diagnosticar la existencia de vasodilatación pulmonar. Una captación cerebral superior al 6% es indicativa de una dilatación vascular pulmonar y se observa en todos los casos de SHP con PaO2<60mmHg; este límite presenta una sensibilidad del 84% y una especificidad del 100% en el diagnóstico del SHP. Por otra parte, esta técnica permite cuantificar el grado de cortocircuito intrapulmonar y no se ve afectado por otras enfermedades respiratorias asociadas. Su principal aplicación es la de cuantificar el grado de shunt y determinar que la hipoxemia se debe principalmente al SHP cuando coexisten una dilatación vascular pulmonar y otras enfermedades respiratorias que contribuyen a la alteración de la oxigenación arterial (PaO2≤ 60mmHg) si la captación cerebral es mayor al 6%.
Este examen, sin embargo, no permite diferenciar entre un shunt intra o extrapulmonar.
Angiografía y TAC de alta resolución:
La angiografía, no obstante, tiene un papel restringido y no se considera en la actualidad una herramienta necesaria para el diagnóstico. Puede mostrar un patrón de daño vascular focal o difuso. En el SHP, la angiografía solo debería realizarse cuando la hipoxemia es severa (ej. PaO2<60mmHg), responde mal a la administración de oxígeno al 100%, y cuando hay una sospecha alta mediante TAC torácica de la existencia de comunicaciones arteriovenosas directas susceptibles de embolización. La TAC de alta resolución torácica puede proporcionar información sobre la forma y distribución de los vasos pulmonares pero su exactitud diagnóstica no está suficientemente establecida.
Pruebas de función respiratoria (PFR), tanto los volúmenes estáticos pulmonares como los resultados de la espirometría forzada están de forma característica dentro de los valores normales en el SHP, siempre y cuando no haya otra comorbilidad pulmonar. La capacidad de difusión del monóxido de carbono (DLCO) es el único test de función pulmonar rutinario anormal de forma consistente en el SHP pero no es específico y no se recomienda como herramienta diagnóstica ni de cribado.
La espirometria estaba dentro de los valores normales en el paciente; presentando alteración en la DLCO.
Pronóstico y sobrevida: El pronóstico es ominoso, ya que la sobrevida es de 16 a 38% a un año del diagnóstico y es aún más limitada si la Pa02 es < 50 mmHg. La presencia del SHP determina una menor sobrevida.
Tratamiento: En la actualidad, el Trasplante hepático(TH) representa la mejor opción terapéutica para los pacientes con SHP e hipoxemia severa. El TH es el único método eficaz de tratamiento capaz de revertir permanentemente la hipoxia del SHP y de conducir a la resolución completa del SHP en la mayoría de los supervivientes. El grado de mejoría de la oxigenación arterial es variable, ocurriendo entre meses y años después del TH y variando según el grado de hipoxemia pretrasplante. Así, se han comunicado casos aislados o pequeñas series de pacientes tratados con análogos de somatostatina, beta-bloqueantes, inhibidores de la ciclooxigenasa, indometacina, glucocorticoides, inmunosupresores como la ciclofosfamida, mofetilmicofenolato (con acción inhibidora de la angiogénesis y de la producción de ON), pentoxifilina (con acción anti-TNF), inhibidores del ON, ON inhalado, vasoconstrictores pulmonares (almitrina), antibióticos para reducir la translocación bacteriana intestinal. Ninguno de estos estudios ha podido demostrar eficacia en cuanto a la mejoría en la oxigenación ni en la vasodilatación pulmonar. No existe terapia farmacológica que haya demostrado un beneficio significativo ni en el intercambio gaseoso ni en la sobrevida; sólo existen algunas series de casos que comunican discretos beneficios hemodinámicos y en el intercambio gaseoso con algunas drogas.
La oxigenoterapia mejora la clínica de estos pacientes y debe administrarse cuando la PaO2 cae por debajo de 60mmHg ya que la hipoxemia crónica per se puede contribuir a la mortalidad por SHP.
La hipoxemia es un criterio adecuado para determinar la progresión de la enfermedad en lista de espera, ya que es una variable específica, objetiva y fácil de obtener. En este contexto, el Grupo de Consenso considera que una PaO2<50mmHg parece un límite adecuado para considerar la exclusión de lista por su alta repercusión sobre la supervivencia postrasplante. Por otra parte, según el algoritmo de la Task Forceon Pulmonary-Hepatic Vascular Disorders, si la hipoxemia es muy grave (PaO2<50mmHg) y/o existe comorbilidad cardiopulmonar, el TH se debe considerar de forma individualizada tras una completa valoración de la severidad y el pronóstico de las condiciones asociadas.
Diagnóstico diferencial de la disnea en pacientes con cirrosis:
Las enfermedades cardiopulmonares intrínsecas quedan descartadas en el paciente debido que tiene una espirometria normal y un ecocardiograma sin evidencia de fallo cardiaco congestivo. No presentaba complicaciones de cirrosis como ascitis, hidrotórax hepático y anemia, como tampoco complicaciones de enfermedades pulmonares específicas. Además del SHP, en la enfermedad hepática se pueden producir otros trastornos de origen vascular que pueden originar hipoxemia y que a menudo se confunden con el SHP. Concretamente, la hipertensión portopulmonar.
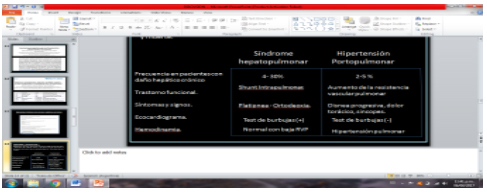
Hipertensión portopulmonar (HTPP):
Obstrucción al flujo en el lecho arterial pulmonar causada por vasoconstricción y proliferación del endotelio vascular y del músculo liso que incrementa las resistencias vasculares pulmonares causando hipoxemia, fallo cardiaco derecho y muerte. En el siguiente cuadro se describen las principales diferencias entre ambas patologías.
Diagnóstico: se basa en confirmar el incremento de la presión y resistencia vascular pulmonar. El cateterismo cardíaco derecho es la prueba de referencia.
La ecocardiografía resulta una prueba excelente, con una seguridad del 95%, y es especialmente útil para excluir la existencia de HTPP con un valor predictivo negativo del 100%.
La prueba, sin embargo, tiene algunas limitaciones; no es específica y el diagnóstico debe confirmarse con el cateterismo cardíaco.
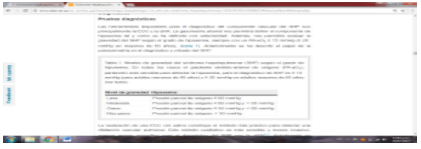
Establecido el diagnóstico, hay que graduar la HTPP para precisar el tratamiento. Si es leve, alcanza una presión de arteria pulmonar media (PAPM) entre 25 y 34 mmHg; la moderada, entre 35 y 44 mmHg, y la grave, mayor de 45 mmHg.
Así, en la HTPP leve y moderada el gasto cardíaco es normal o elevado y la resistencia vascular pulmonar, moderadamente alta. Por el contrario, en la HTPP grave el gasto cardíaco declina y la resistencia es enorme.
Tratamiento: Los criterios de selección para el trasplante se basan en la evaluación de la presión arterial pulmonar, función ventricular y respuesta a los vasodilatadores. Se considera que la HTPP leve (PAPM entre 25 y 34 mmHg) es reversible tras el trasplante y tiene un riesgo perioperatorio aceptable; por el contrario, cuando la PAPM es mayor de 35 mmHg y la resistencia vascular pulmonar superior a 250 din·sg·cm, el riesgo es inaceptable. El dilema surge cuando la PAPM se sitúa entre 30 y 50 mmHg.
El tratamiento de la HTPP con vasodilatadores es sólo paliativo y, también en este caso, el trasplante hepático es la solución definitiva. No obstante, se asumirá el elevado riesgo perioperatorio del procedimiento, exclusivamente, en aquellos casos en que la hipertensión pulmonar es moderada y la vasculopatía responde a los vasodilatadores.
El paciente presenta un cateterismo sin hipertensión pulmonar por lo tanto esta patología queda descartada.
Recomendaciones para el Tratamiento de la Hepatitis Crónica por Virus C
La hepatitis C no siempre requiere tratamiento, porque en algunas personas la respuesta inmunitaria eliminará la infección espontáneamente y algunas personas con infección crónica no llegan a presentar daño hepático. El sofosbuvir, el daclatasvir y la combinación de sofosbuvir/ledipasvir forman parte de los tratamientos preferidos en las directrices de la OMS, y pueden lograr tasas de curación superiores al 95%.
Objetivos del tratamiento
El objetivo final del tratamiento, en la práctica, es lograr la respuesta virológica sostenida (RVS), definida por un RNA de virus de hepatitis C (HCV) en sangre no detectable a las 12 semanas (RVS 12) o a las 24 semanas (RVS 24) después de haber finalizado el tratamiento, utilizando un método molecular sensible con un límite inferior de detección, de 15 UI/ml.
Indicaciones de tratamiento:
• Pacientes con fibrosis significativa, avanzada o cirrosis, con estadios de fibrosis F2, F3 o F4, incluyendo pacientes descompensados (equivalente a Fibroscan ≥8 o Fibrotest ≥0,5).
• Pacientes con manifestaciones extrahepáticas clínicamente significativas, por ejemplo: clínica asociada a crioglobulinemia, nefropatía relacionada a complejos inmunes, linfoma de células B, diabetes, porfiria cutánea tarda, otras.
• Pacientes con recurrencia post trasplante hepático.
• Pacientes con trasplante de otros órganos sólidos o en lista de espera de trasplante.
• Pacientes con hepatitis C aguda.
• Pacientes con alto riesgo de trasmitir el HCV o en quienes el tratamiento puede disminuir la transmisión.
Las recomendaciones de la AAEEH para el tratamiento de la hepatitis C crónica con los medicamentos disponibles se efectúan teniendo en cuenta genotipo, subtipo, tratamiento previo y presencia o ausencia de cirrosis.
Los pacientes con función hepática conservada (Child A), que tienen indicación de trasplante por hepatocarcinoma (HCC) pueden ser tratados con todos los esquemas terapéuticos por períodos de 12 a 24 semanas. Los pacientes cirróticos descompensados, con enfermedad avanzada (Child B, C), pueden recibir el esquema de sofosbuvir, daclatasvir y ribavirina por 12 semanas (24 semanas en genotipo 3), sin embargo, los datos de seguridad son limitados en pacientes con enfermedad muy grave (MELD > 20 o Child> 12 puntos), por lo que en este grupo debería considerarse la indicación de trasplante hepático antes de tratar.
Debe monitorearse de forma estricta la recurrencia del HCC en los pacientes que hayan recibido un tratamiento curativo.
El paciente presentaba genotipo 3a, por lo que realizó tratamiento con sofosbuvir + declatasvir. Antes de iniciar el tratamiento debe determinarse la presencia de RASs basales para NS5A Y93H y tratarse con ribavirina; en la ausencia de dicho gen puede tratarse sin ribavirina. En el paciente no se determinó la presencia de dicho gen, y el tratamiento con ribavirina no fue indicado debido a uno de los efectos adversos presente en este fármaco que es la anemia.
Para concluir este caso, estamos frente a un varón de 49 años de edad, con antecedente de Hepatitis C genotipo 3ª por lo que realizó tratamiento con antivíricos de acción directa con respuesta virológica sostenida. Por presentar al ingreso platipnea y ortodeoxia se realiza ecocardiograma doppler con burbujas, con resultado positivo luego de la aparición de microburbujas entre el 3 y 6 latido, confirmando el diagnostico de síndrome hepatopulomar. Al ingreso se plantea la posibilidad de trasplante hepático debido a la presencia de hipoxemia grave, por dicho motivo se realiza cateterismo cardiaco derecho, donde se descarta hipertensión pulmonar y ecocardiograma con stress el cual es negativo para angor. Por lo antes mencionado, propongo la realización del trasplante hepático, ya que es la mejor opción terapéutica para la resolución del síndrome hepatopulmonar y la hipoxemia severa.
BIBLIOGRAFIA:
-
T. THENAPPAN,A. GOEL,G. MARSBOOM,Y.H. FANG,P.T. TOTH,H.J. ZHANG. A central role for CD68(+) macrophages in hepatopulmonary syndrome. reversal by macrophage depletion Am J RespirCrit Care Med., 183 (2011), pp. 1080-1091.
-
GastroenterolHepatol 2015;38:398-408 10.1016. Heptopulmonarysíndrome.
-
J. ZHANG,W. YANG,B. LUO,B. HU,A. MAHESHWARI,M.B. FALLON. The role of CX(3)CL1/CX(3)CR1 in pulmonary angiogenesis and intravascular monocyte accumulation in rat experimental hepatopulmonary syndrome. J Hepatol., 57 (2012), pp. 752-758.
-
K.E. ROBERTS,S.M. KAWUT,M.J. KROWKA,R.S. BROWN JR.,J.F. TROTTER,V. SHAH.Genetic risk factors for hepatopulmonary syndrome in patients with advanced liver disease Gastroenterology, 139 (2010), pp. 130-139
-
R. RODRIGUEZ-ROISIN,M.J. KROWKA,P. HERVE,M.B. FALLON -ERS Task Force Pulmonary-Hepatic Vascular Disease (PHD) Scientific Committee. Pulmonary-hepatic vascular disorders (PHD),24 (2004), pp. 861-880.
-
HERVE R LE PAVEC J, SZTRYMF B, DECANTE B, SAVALE L, SITBON O. Pulmonary vascular abnormalities in cirrhosis. Best Pract Res ClinGastroenterol 2007; 21: 141-59.
-
F.ALDENKORTT,M. ALDENKORTT,L. CAVIEZEL,J.L. WAEBER,A. WEBER,E. SCHIFFER. Portopulmonary hypertension and hepatopulmonary syndrome. World J Gastroenterol., 20 (2014), pp. 8072-8081
-
V.I. MACHICAO,M. BALAKRISHNAN,M.B. FALLON. Pulmonary complications in chronic liver disease.Hepatology., 59 (2014), pp. 1627-1637.
-
G. TUMGOR. Cirrhosis and hepatopulmonary syndrome. World J Gastroenterol, 20 (2014), pp. 2586-2594.
-
D.N. ROBERTS, M.R. ARGUEDAS, M.B. FALLON. Cost-effectiveness of screening for hepatopulmonary syndrome in liver transplant candidates.Liver Transpl., 13 (2007), pp. 206-214.
-
V.N. IYER,K.L. SWANSON,R. CARTIN-CEBA,R.A. DIERKHISING,C.B. ROSEN,J.K. HEIMBACH. Hepatopulmonary syndrome: favorable outcomes in the MELD exception eraHepatology., 57 (2013), pp. 427-2435
-
American Association for the Study of Liver Disease (AASLD).
-
HOEPER MM, BOGAARD HJ, CONDLIFFE R, FRANTZ R, KHANNA D, KURZYNA, ET. Definition and Diagnosis of pulmonary hypertension. J Am CollCardiol 2013; 62 (25 Suppl D):D42-D50. WorldExpertSymposioNice 2013.
-
N. GALIÈ, M. M. HOOPER,M. HUMBERT,A. TORBICKI,J.L. VACHIERY Guidelines for the Diagnosis and Treatment of Pulmonary Hypertension. The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS).Endorse by International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J, 30 (2009), pp. 2493-2537.
-
European Association for Study of Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol. 2016
|
Imágenes del caso
|